デマの内容
「2021年7月21日、CDCはPCR検査が信頼できないことを認め、PCR検査の緊急使用許可を取り消すことに決めた」と主張する人がいますが、デマです。

https://twitter.com/lkj_hgf_dsa_poi/status/1419592840271728641
結論
CDCの発表は、「CDCが緊急使用許可(EUA)を得ていた古いPCR検査の使用をやめ、民間が独自にEUAを得て使用しているより新しく効率的なPCR検査への移行をすすめていく」というものであり、PCR検査の信頼性に疑念を呈するようなことは一切述べておらず、PCR検査そのものが無くなることを意味していません。
解説
ファクトチェック記事(FactCheck.org)
FactCheck.orgによるファクトチェック記事からの抜粋です。
Viral Posts Misrepresent CDC Announcement on COVID-19 PCR Test
CDCの新型コロナPCR検査の発表に関するデマ
The agency in a July 21 notice recommended that labs use “one of the many FDA-authorized alternatives” and said it “encourages laboratories to consider adoption of a multiplexed method that can facilitate detection and differentiation of SARS-CoV-2 and influenza viruses.”
CDCは、2021年7月21日の通知で、「FDAが承認した多くの代替手段の1つ」を使用するように研究機関に対して推奨し、新型コロナウイルスとインフルエンザウイルスの検出と識別が容易にできるマルチプレックス(多重化)方式の採用を検討するよう奨励しました。
Such multiplex tests, including one from the CDC, can look for both the novel coronavirus and multiple types of influenza at the same time — which conserves testing materials and allows public health labs to do influenza surveillance while testing for SARS-CoV-2, or the virus that causes COVID-19.
CDCが推奨するものを含め、このようなマルチプレックス検査では、新型コロナウイルスと複数種類のインフルエンザの両方を同時に検知することができます。また、検査材料の節約になり、公衆衛生研究所が新型コロナウイルスの検査をしながらインフルエンザの調査も行うことができます。
But the CDC did not say it was no longer supporting the use of PCR tests in general, many of which have been authorized by the FDA — or that its original PCR test for SARS-CoV-2 can’t tell the difference between coronavirus and influenza — as viral posts spreading online falsely claim.
オンラインで拡散している話とは異なり、FDAによって承認されている多くの一般的なPCR検査の使用についてCDCはサポートしないとは述べておらず、CDC独自の新型コロナウイルスPCR検査がコロナウイルスとインフルエンザの違いを判別できないとも述べていません。
the announcement in question came from the CDC and was about plans for the eventual discontinuation of its own test.
この件はCDCが発表したものですが、その内容は、CDC独自の検査の中止計画について述べたものです。
The FDA did not revoke the CDC test’s emergency use authorization or question the reliability of PCR tests, an FDA spokesman confirmed to us.
FDAのスポークスマンによれば、FDAはCDCの検査の緊急使用許可を取り消してはおらず、PCR検査の信頼性に疑問を呈するようなこともしていません。
Scientists consider PCR tests a reliable and highly specific diagnostic tool, as we’ve explained before, but distortions about them have persisted amid the COVID-19 pandemic.
以前にも解説したように、PCR検査は信頼性が高く、非常に有効な診断ツールであると科学者たちは考えていますが、新型コロナのパンデミックの中で、PCR検査に関するデマが後をたちません。
In explaining the CDC’s decision to end the use of its own PCR test at the end of 2021, Kristen Nordlund, an agency spokeswoman, in an email to us cited “the availability of commercial options for clinical diagnosis of SARS-CoV-2 infection, including multiplexed (discussed here) and high-throughput options” — referring to technologies that use an automated process to administer hundreds of tests per day.
2021年末に独自のPCR検査の使用を終了するというCDCの決定を説明するにあたり、政府機関のスポークスウーマンであるクリステン・ノードランド(Kristen Nordlund)は、Eメールで、1日に数百の検査を自動処理するテクノロジーに言及し、「新型コロナウイルスの臨床診断(マルチプレックスおよび大量処理を含む)に関して民間を利用する選択肢」について述べました。
Jim McKinney, an FDA spokesman, told us in an email that to date, “the FDA has authorized more than 380 tests and sample collection kits to diagnose COVID-19, many of which are PCR tests. PCR tests are generally considered to be the ‘gold standard’ for COVID-19 diagnosis.”
FDAのスポークスマンであるジム・マッキニー(Jim McKinney)は、これまでに電子メールで次のように述べています。「FDAは、新型コロナを診断するために380を超える検査とサンプル収集キットを承認しており、その多くはPCR検査です。PCR検査は、一般的に新型コロナ診断の「ゴールドスタンダード」と見なされています。」
“The FDA has not issued any statement questioning the reliability of PCR test results in general and will continue to consider authorization for validated PCR tests,” he added.
「FDAは、一般的なPCR検査の信頼性を疑うような声明を発表しておらず、検証済みのPCR検査の認可を引き続き検討していきます」
Dr. Michael Mina, a Harvard University assistant professor of epidemiology, told us that the CDC’s decision regarding its test made sense, given how the landscape has changed.
ハーバード大学の疫学助教授であるマイケル・ミナ博士は、状況の変化を考慮すれば、検査についてのCDCの決定は理にかなっていると語った。
“CDC is likely going to pull its own EUA for its test because hundreds of other labs now have their own EUAs and CDC no longer even needs to use its own test since many companies now have EUAs for manufactured tests,” he said in an email.
「CDCは検査のための独自の緊急使用許可(EUA)を取得しなくなるかもしれません。なぜなら、現在、他の何百もの研究機関が独自の緊急使用許可(EUA)を得ており、多くの企業が製造テスト用の緊急使用許可(EUA)を取得しているため、CDCは独自の検査を使用する必要がなくなったためです」と彼は電子メールで述べました。
“The major Companies like Roche, Hologic, Abbott all have their own test kits and instruments. Then the Thermo Fishers of the world have EUAs for their PCR kits that can be run in the exact same way as the CDC assay. So there really is no reason for CDC to retain their EUA.”
「ロシュ、ホロジック、アボットなどの主要企業はすべて、独自の検査キットと機器を持っています。そして、サーモフィッシャーは、CDCアッセイとまったく同じ方法で実行できるPCRキット用の緊急使用許可(EUA)を世界中で取得しています。したがって、CDCが緊急使用許可(EUA)を保持する理由は、実際のところ、ありません。」
Mina said the move had to be done carefully, since some public health labs may currently be relying on the CDC’s test.
ミナ氏は、一部の公衆衛生研究所は現在CDCの検査に依存している可能性があるため、移行は慎重に行う必要があると述べた。
CDCが公開した記事
CDCが公開した記事「07/21/2021: Lab Alert: Changes to CDC RT-PCR for SARS-CoV-2 Testing」がこちらです。
07/21/2021: Lab Alert: Changes to CDC RT-PCR for SARS-CoV-2 Testing
2021年7月21日:研究機関向けの警告:新型コロナウイルス検査 CDC RT-PCR に関する変更
After December 31, 2021, CDC will withdraw the request to the U.S. Food and Drug Administration (FDA) for Emergency Use Authorization (EUA) of the CDC 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel, the assay first introduced in February 2020 for detection of SARS-CoV-2 only.
CDCは、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の緊急使用許可(EUA)を、2021年12月31日以降から、FDA(米国食品医薬品局)に要請しないこととします。この検査は、新型コロナウイルスのみを検知するために、2020年2月に最初に導入されたアッセイ(方法)です。
CDC is providing this advance notice for clinical laboratories to have adequate time to select and implement one of the many FDA-authorized alternatives.
CDCによるこの事前通知の目的は、臨床検査室に十分な準備期間(FDAが承認した多くの代替案のいずれかを選択し、実装する時間)を提供することです。
Visit the FDA website for a list of authorized COVID-19 diagnostic methods.
認可された新型コロナ診断方法のリストについては、FDAのWebサイトにアクセスしてください。
For a summary of the performance of FDA-authorized molecular methods with an FDA reference panel, visit this page.
FDAリファレンスパネルを使用したFDA認可の分子法の性能の概要については、このページにアクセスしてください。
In preparation for this change, CDC recommends clinical laboratories and testing sites that have been using the CDC 2019-nCoV RT-PCR assay select and begin their transition to another FDA-authorized COVID-19 test.
この変更に備えて、CDCは、CDC 2019-nCoV RT-PCR アッセイを使用している臨床検査室と検査サイトに対して、FDAが承認した別の新型コロナ検査を選択して移行を開始するように推奨しています。
CDC encourages laboratories to consider adoption of a multiplexed method that can facilitate detection and differentiation of SARS-CoV-2 and influenza viruses.
CDCは、新型コロナウイルスとインフルエンザウイルスの検出と識別を容易に行うことが可能な、マルチプレックス法の採用を検討するよう研究所に奨励しています。
Such assays can facilitate continued testing for both influenza and SARS-CoV-2 and can save both time and resources as we head into influenza season.
このようなアッセイは、インフルエンザと新型コロナウイルスの両方を継続的に検査することを容易にし、インフルエンザ・シーズンを迎えるときに時間とリソースの両方を節約できます。
Laboratories and testing sites should validate and verify their selected assay within their facility before beginning clinical testing.
研究所および検査サイトは、臨床試験を開始する前に、選択したアッセイを施設内で確認および検証する必要があります。
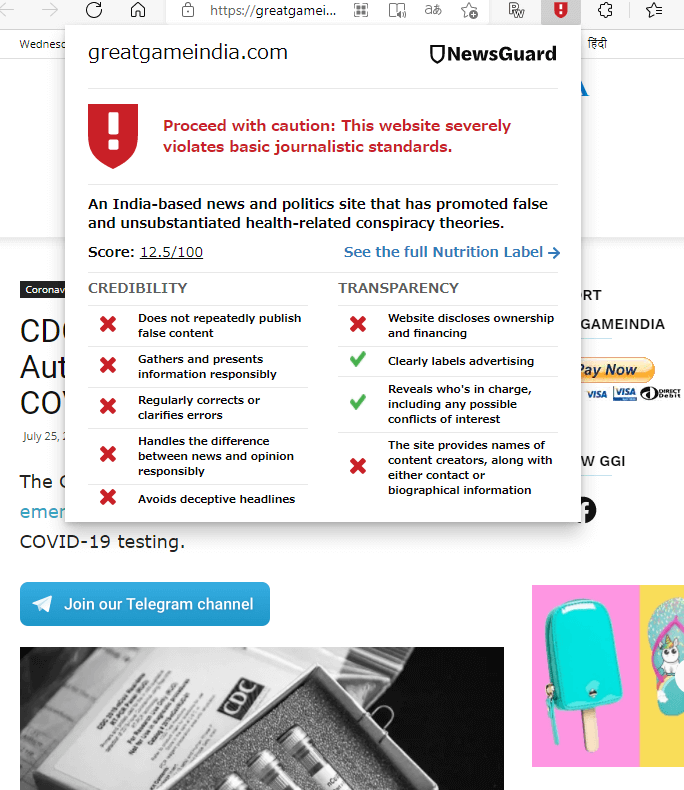
NewsGuardによるチェック
ちなみに、デマッターが引用しているデマ元らしきサイトをNewsGuardで見てみると「注意が必要です:この Web サイトは報道倫理規定に著しく違反しています」という警告が出ます。
FDAが認可した診断方法の中にPCR検査が無い?!
「FDAが認可した診断方法の中にPCR検査が無いじゃないか!」と主張する人がいましたが、ちゃんとあります。
下図の赤線を引いた molecular tests(分子検査)というカテゴリーに RT-PCR 検査も含まれています(その他の分子検査としては LAMP 法がよく知られています)。
従来のPCR検査ではインフルエンザと新型コロナの区別がついてましたか?!
「インフルエンザと新型コロナを同時に判定できるPCR検査がこれから推奨になるということは、いままでインフルエンザと新型コロナの区別がついてなかったということですか?」という質問をしてくる方がいます。
いいえ。これまでも明確に区別はついてました(当然)。
これまでは、
- 新型コロナのみを対象に陽性・陰性を判定するPCR検査
- 新型コロナとインフルエンザを同時に区別して判定できるマルチプレックスPCR検査
が混在して使用されていました。このうち、新型コロナのみを対象としていたPCR検査をやめて、マルチプレックスPCR検査などを含めた最新の検査に移行していくということです。そうすれば検査の材料も手間も省けますから。
従来の新型コロナのみを対象としたPCR検査も、ウイルスの遺伝子(人間の指紋のようなもの)を調べる検査なので、当然ながら非常に正確です。インフルエンザウイルスと新型コロナウイルスを間違えて判定することはありません。
CDCからの補足説明
2021年8月2日、この件に関してCDCから補足説明が出たので、そのほぼ全文の原文・訳文を掲載します。
08/02/2021: Lab Alert: Clarifications about the Retirement of the CDC 2019 Novel Coronavirus (2019-nCov) Real-Time RT-PCR Diagnostic Panel
2021年8月2日:ラボアラート:「CDC 2019 新型コロナウイルス(2019-nCov)リアルタイム RT-PCR 診断パネル」の廃止に関する説明
Why is CDC retiring the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel?
CDC が「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」を廃止するのはなぜですか?
CDC is retiring the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel because the U.S. Food and Drug Administration (FDA) has authorized hundreds of other SARS-CoV-2 diagnostic tests, many of which are now higher throughput or can test for more than one illness at a time. At the time CDC deployed the 2019-nCoV Real-Time RT-PCR Diagnostic Panel, there were no other FDA-authorized methods available within the United States.
CDC は「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」を廃止する予定です。なぜなら、現在では FDA(米国食品医薬品局)が他の何百もの新型コロナ診断検査を承認しているからです。その検査の多くは短時間に大量の処理が可能であり、または、一度に複数の病気の検査をすることができます。CDC が「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」を展開した当時、米国内で FDA から承認されている他の利用可能な検査はありませんでした。
CDC began distributing the CDC 2019 Novel Coronavirus (2019-nCOV) Real-Time RT-PCR Diagnostic Panel to fill a gap. The wide availability of other SARS-CoV-2 diagnostic tests means that the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel is no longer filling an unmet need. Retiring the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel will allow CDC to focus its resources on public health surveillance testing and other response activities.
CDCは、需要を満たすために、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」の配布を開始しました。しかし、他の多くの新型コロナウイルス診断検査が利用できるならば、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」はもはや需要を満たしていないことを意味します。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」を廃止することで、CDCはそのリソースを公衆衛生の監視検査およびその他の対応活動に振り向けることができます。
CDC is recommending that laboratories that routinely conduct influenza testing as well as COVID-19 testing, such as public health laboratories, consider transitioning to a test that can generate a result for both influenza and SARS-CoV-2, rather than running separate tests for each virus. The CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay, one such assay available to public health laboratories, can simultaneously detect and differentiate SARS-CoV-2, Influenza A, and Influenza B with one test. It is a more resource-efficient way for public health laboratories to meet influenza and SARS-CoV-2 surveillance goals.
インフルエンザ検査と新型コロナ検査を定期的に実施している研究所(公衆衛生研究所など)は、それらの検査を別々に行うのではなく、両方の検査結果を出力できる検査へ移行するよう CDC は推奨しています。たとえば、公衆衛生研究所で利用できる「CDC Influenza SARS-CoV-2(Flu SC2)マルチプレックス・アッセイ」は、1回の検査で新型コロナウイルス/インフルエンザA/インフルエンザBを同時に検出し識別することができます。公衆衛生研究所でこれを使用すれば、インフルエンザと新型コロナの監視に費やすリソースを節約できます。
Does the retirement of this test apply to all RT-PCR-based tests or all SARS-CoV-2 tests that have received Emergency Use Authorization from FDA?
検査の廃止は、すべての RT-PCR ベースの検査(FDA から緊急使用許可を受けたすべての新型コロナ検査)に適用されますか?
No. The discontinuation of Emergency Use Authorization (EUA) only applies to the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel test. It does not affect any other SARS-CoV-2 test that has received EUA from FDA.
いいえ。緊急使用許可(EUA)の廃止は、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル検査」のみに適用されます。FDA から緊急使用許可を受けている他の新型コロナ検査には影響しません。
Does the retirement of this test affect any other CDC tests for SARS-CoV-2?
この検査の廃止は、CDC の他の新型コロナ検査に影響しますか?
No. The CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay received EUA from FDA in July 2020, and its status is not impacted by the decision to retire the CDC 2019 Novel Coronavirus Real-Time RT-PCR Diagnostic Panel. CDC and public health laboratories continue to use the CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay.
いいえ。2020年7月にFDAから緊急使用許可を得た「CDC Influenza SARS-CoV-2(Flu SC2)マルチプレックス・アッセイ」およびそのステータスは、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の廃止の決定による影響を受けません。CDCおよび公衆衛生研究所は、引き続き「CDC Influenza SARS-CoV-2(Flu SC2)マルチプレックス・アッセイ」を使用します。
Was the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel revoked because it failed its review by FDA?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は、FDA の審査に不合格になったから取り消されたのですか?
No. The CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel did not fail a full review and was not revoked by the FDA.
いいえ。「CDC2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は、完全な審査に不合格にはなっておらず、FDA に取り消されてはいません。
Is CDC retiring the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel because it has produced inaccurate results?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」が不正確な結果を出したから廃止するのですか?
No. There are no performance concerns with this test. The CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel is a highly accurate test. It has been used to successfully detect SARS-CoV-2 since February 2020.
いいえ。この検査に性能上の懸念はありません。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は非常に正確な検査です。この検査により、2020年2月から、新型コロナウイルスを正しく検出できています。
Since the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel continues to perform well, CDC will continue to make the design of the primers and probes used in the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel publicly available on the CDC website. Laboratories and test developers are free to use the design in their own research or diagnostic test.
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は引き続き良好に機能するため、CDC は「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」で使用されているプライマーとプローブの設計を CDC の Webサイトで公開し続けます。研究所と検査開発者は、その設計を独自の研究または診断検査で自由に使用できます。
CDC will also continue to extend Right of Reference to anyone who wishes to reference the data in CDC’s Emergency Use Authorization (EUA 200001) to support their own regulatory submission to FDA. The retirement of the test and the discontinuation of the associated EUA will have no impact on the availability of the design or Right of Reference. The CDC submission will remain on file at FDA.
CDC はまた、希望するすべての人が CDC の緊急使用許可(EUA 200001)のデータを参照できるように参照権の拡張を続け、FDA への書類提出をサポートしていきます。該当検査の廃止および関連する緊急使用許可の中止は、設計の利用または参照権に影響を与えません。CDC が FDA に提出した書類は FDA でファイルされ続けます。
Does the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel detect both SARS-CoV-2 (the virus that causes COVID-19) and influenza (flu)?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は、新型コロナウイルス(新型コロナを引き起こすウイルス)とインフルエンザウイルスの両方を検出しますか?
No. The CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel was specifically designed to only detect SARS-CoV-2 viral genetic material. It does not detect influenza or differentiate between influenza and SARS-CoV-2. The presence of influenza viral genetic material within a specimen will not cause a false positive result.
いいえ。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は、新型コロナウイルスの遺伝物質のみを検出するように特別に設計されました。インフルエンザウイルスを検出することはなく、インフルエンザウイルスと新型コロナウイルスを区別するものでもありません。検体内にインフルエンザウイルスの遺伝物質が存在していたとしても、検査結果が偽陽性になることはありません。
There are other multianalyte tests available, including the CDC Influenza SARS-CoV-2 Multiplex Assay, that can simultaneously detect and differentiate Influenza A, Influenza B, and SARS-CoV-2.
その他の多検体検査(「CDC インフルエンザ SARS-CoV-2 マルチプレックス・アッセイ」を含む)を使用すれば、インフルエンザA/インフルエンザB/新型コロナウイルスを同時に検出および区別することができます。
Does the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel confuse influenza with SARS-CoV-2?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」はインフルエンザウイルスと新型コロナウイルスを混同しますか?
No. The CDC 2019-nCoV Real-Time RT-PCR Diagnostic Panel does not confuse influenza with SARS-CoV-2. It is a highly accurate test that detects the presence or absence of SARS-CoV-2 viral genetic material within a patient specimen.
いいえ。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」は、インフルエンザウイルスと新型コロナウイルスを混同しません。これは、患者の検体内に新型コロナウイルスの遺伝物質が存在するかどうかを非常に正確に判定できる検査です。
Does the retirement of the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time PCR Diagnostic Panel mean that the previous results from this test are invalid?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の廃止は、この検査の以前の結果が無効であることを意味しますか?
No. Results from this test are reliable, valid, and specific to SARS-CoV-2.
いいえ。新型コロナウイルス固有のこの検査の結果は、信頼性が高く有効です。
Are RT-PCR-based tests valid for the detection of SARS-CoV-2?
RT-PCR ベースの検査は新型コロナウイルスの検出に有効ですか?
Yes. RT-PCR-based tests are one type of laboratory-based nucleic acid amplification test (NAAT), which continue to be the “gold standard” of diagnostic testing for COVID-19. Many diagnostic tests for SARS-CoV-2 that have received EUA from FDA use RT-PCR-based tests, including both the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel and the CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay.
はい。RT-PCR ベースの検査は、研究室ベースの核酸増幅検査(NAAT)の一種であり、新型コロナ診断検査の「ゴールドスタンダード」であり続けています。FDA から緊急使用許可を受けた新型コロナウイルス診断検査の多くは、RT-PCR ベースの検査を使用しています。これには「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」および「CDC Influenza SARS-CoV-2(Flu SC2)マルチプレックス・アッセイ」も含まれます。
What tests can laboratories and testing sites use instead of the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel?
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の代わりに、研究所や検査サイトで使用できる検査は何ですか?
CDC encourages public health laboratories to adopt the CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay for the simultaneous surveillance testing of both SARS-CoV-2 and influenza. The test specifies whether a patient specimen is positive for SARS-CoV-2, influenza, or both.
公衆衛生研究所が新型コロナウイルスとインフルエンザウイルスの両方を同時に監視し検査する手段として、「CDC Influenza SARS-CoV-2(Flu SC2)マルチプレックス・アッセイ」を採用するように CDC は推奨しています。この検査では、患者の検体が新型コロナウイルス/インフルエンザウイルス/その両方に陽性であるかどうかを判定できます。
Clinical laboratories that use a SARS-CoV-2 diagnostic test based on the CDC EUA of February 2020 should visit the FDA website for a list of authorized COVID-19 diagnostic molecular methods.
2020年2月の CDC 緊急使用許可に基づく新型コロナウイルス診断検査を使用している臨床検査室は、認可されている新型コロナ診断分子法のリストについて FDA の Web サイトを参照する必要があります。
What if a laboratory or testing site is using a test with Right of Reference to the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel?
研究所または検査サイトが「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」への参照権を持つ検査を使用している場合はどうなりますか?
Tests that use the Right of Reference to the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel and that have received their own EUA from FDA are not affected by the retirement of the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel. CDC will continue to extend Right of Reference to anyone who wishes to reference CDC’s EUA for the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel in their own regulatory submission. Even after the CDC requests that the authorization for the CDC 2019-nCoV Real-Time RT-PCR Diagnostic Panel be discontinued, the submission will remain on file at FDA.
「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の参照権を使用し、FDA から独自の緊急使用許可を得ている検査は、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の廃止の影響を受けません。書類提出のために「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の緊急使用許可の参照を希望するすべての人に対して、CDC は引き続き参照権を拡大していきます。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」の承認の停止要求の後も、提出書類は FDA にファイルされ続けます。
Can laboratories and testing sites continue to use the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel?
研究所や検査サイトは、「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」を引き続き使用できますか?
Yes. Because there are no performance concerns with the CDC 2019 Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel, laboratories and testing sites may continue to use this test until it is retired at the end of December 2021. CDC is making this announcement now to give laboratories and testing sites time to select and shift to one of the many other FDA-authorized tests.
はい。「CDC 2019 新型コロナウイルス(2019-nCoV)リアルタイム RT-PCR 診断パネル」には性能上の懸念がないため、研究所および検査サイトは、2021年12月末に廃止されるまで、この検査を引き続き使用できます。研究所と検査サイトに対して、FDA から認可された他の多くの検査のいずれかを選択して移行する猶予を与えるために、CDC はこの発表を行っています。
Opt in to receive updates from the CDC Laboratory Outreach Communication System (LOCS).
LOCS(CDC と研究所のためのコミュニケーションシステム)からアップデートを受けるためのオプトイン
その他の参考記事
「CDCがPCR検査取りやめを発表」はデマ(伊賀治氏ノート)
https://note.com/osamu_iga/n/naee903ea32bc
APファクトチェック
CDC encourages use of new tests that detect both COVID-19 and the flu
 ほえのブログ
ほえのブログ